Difference between revisions of "Ozone"
| Ligne 4: | Ligne 4: | ||
L'ozone est un gaz très réactionnel. Des études ont montré qu'il pouvait être détecté sur des distances moyennes de l'ordre de 50 km en aval des agglomérations importantes. Les molécules d'ozone détectées dans ces zones ne sont cependant pas forcément celles qui existaient dans la zone urbaine, lors du passage de la masse d'air. L'ozone est impliqué dans des réactions de formation et de destruction. Tant que les conditions météorologiques, les concentrations en NOx et COV, ainsi que l'ensoleillement le permettent, les deux types de réaction cohabitent. Durant la nuit, seules les réactions de destruction subsistent et la concentration en ozone diminue lentement. | L'ozone est un gaz très réactionnel. Des études ont montré qu'il pouvait être détecté sur des distances moyennes de l'ordre de 50 km en aval des agglomérations importantes. Les molécules d'ozone détectées dans ces zones ne sont cependant pas forcément celles qui existaient dans la zone urbaine, lors du passage de la masse d'air. L'ozone est impliqué dans des réactions de formation et de destruction. Tant que les conditions météorologiques, les concentrations en NOx et COV, ainsi que l'ensoleillement le permettent, les deux types de réaction cohabitent. Durant la nuit, seules les réactions de destruction subsistent et la concentration en ozone diminue lentement. | ||
| + | |||
| + | ===Interactions avec d'autres polluants=== | ||
| + | |||
| + | L'ozone est un polluant secondaire, c'est-à-dire, qu'à de rares exceptions près, il n'est pas émis directement par l'activité humaine, mais est formé par des processus chimiques complexes à partir d'autres polluants, appelés précurseurs. Cette caractéristique rend la lutte contre la pollution par l'ozone difficile et diminuer la pollution pour un polluant précurseur peut mener à des effets négatifs et augmenter ainsi les taux d'ozone. | ||
| + | |||
| + | ===Les oxydes d'azote=== | ||
| + | |||
| + | Les différentes réactions entre l'ozone et les oxydes d'azote peuvent se résumer par l'équilibre suivant : | ||
| + | |||
| + | NO2 + O2 + hv a O3 + NO | ||
| + | |||
| + | L'ozone est formé par réaction entre le dioxyde d'azote et l'oxygène atmosphérique en présence de radiation solaire. La réaction inverse est possible : l'ozone est détruit par le monoxyde d'azote pour donner du dioxyde d'azote. Si la formation d'ozone est un phénomène lent (plusieurs heures), la destruction par le NO est rapide (quelques minutes). | ||
| + | |||
| + | Il existe un équilibre entre ces réactions de formation-destruction et, dans les conditions normales, le taux d'ozone reste stationnaire. Cet équilibre peut être brisé par la présence de Composés Organiques Volatils (COV5) avec, pour conséquence, une augmentation de la teneur en ozone. | ||
| + | |||
| + | Les variations nycthémérales (c'est-à-dire les variations de concentrations selon un rythme de 24 heures) de l'ozone résultent de cet équilibre. La journée, sous l'influence des rayons solaires, l'ozone est formé à partir du dioxyde d'azote (la destruction continue, mais l'effet global observé est une augmentation de l'ozone). Pendant la nuit, seule la réaction de destruction subsiste et l'ozone diminue en formant une «réserve» de dioxyde d'azote qui pourra reformer de l'ozone le jour suivant. | ||
| + | |||
| + | En été, on observe une augmentation de la concentration d'ozone entre 10 et 21 h, puis une diminution, due au processus de destruction. Les variations d'ozone dépendent de sa destruction plus ou moins forte et, selon le type d'environnement, il existe des différences notables entre ces variations nycthémérales. | ||
| + | |||
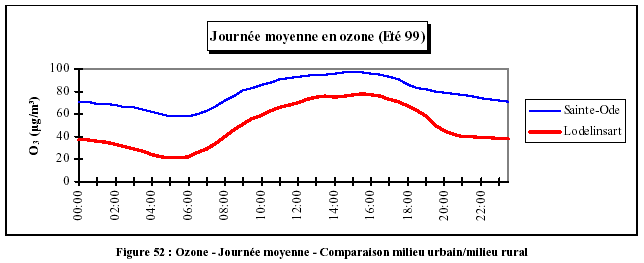
| + | Dans un environnement urbain, la production d'ozone est forte pendant la journée et sa destruction est rapide pendant la nuit. Les pics sont bien marqués, alors qu'en milieu rural et en l'absence de NO, la destruction est plus faible et les variations sont moindres, bien que le niveau général soit plus élevé (ligne de base plus haute). | ||
| + | |||
| + | [[image:ozone-belgique-moyenne.gif]] | ||
Version du 11:09, 4 novembre 2005
L'ozone présente la particularité de n'être pratiquement pas émis par des sources naturelles ou anthropogéniques : il est en fait un polluant secondaire dû à l'action de la lumière sur certains polluants. Les mécanismes de production de l'ozone sont largement décrits au § 1.2.2.3.
Sommaire
Transport
L'ozone est un gaz très réactionnel. Des études ont montré qu'il pouvait être détecté sur des distances moyennes de l'ordre de 50 km en aval des agglomérations importantes. Les molécules d'ozone détectées dans ces zones ne sont cependant pas forcément celles qui existaient dans la zone urbaine, lors du passage de la masse d'air. L'ozone est impliqué dans des réactions de formation et de destruction. Tant que les conditions météorologiques, les concentrations en NOx et COV, ainsi que l'ensoleillement le permettent, les deux types de réaction cohabitent. Durant la nuit, seules les réactions de destruction subsistent et la concentration en ozone diminue lentement.
Interactions avec d'autres polluants
L'ozone est un polluant secondaire, c'est-à-dire, qu'à de rares exceptions près, il n'est pas émis directement par l'activité humaine, mais est formé par des processus chimiques complexes à partir d'autres polluants, appelés précurseurs. Cette caractéristique rend la lutte contre la pollution par l'ozone difficile et diminuer la pollution pour un polluant précurseur peut mener à des effets négatifs et augmenter ainsi les taux d'ozone.
Les oxydes d'azote
Les différentes réactions entre l'ozone et les oxydes d'azote peuvent se résumer par l'équilibre suivant :
NO2 + O2 + hv a O3 + NO
L'ozone est formé par réaction entre le dioxyde d'azote et l'oxygène atmosphérique en présence de radiation solaire. La réaction inverse est possible : l'ozone est détruit par le monoxyde d'azote pour donner du dioxyde d'azote. Si la formation d'ozone est un phénomène lent (plusieurs heures), la destruction par le NO est rapide (quelques minutes).
Il existe un équilibre entre ces réactions de formation-destruction et, dans les conditions normales, le taux d'ozone reste stationnaire. Cet équilibre peut être brisé par la présence de Composés Organiques Volatils (COV5) avec, pour conséquence, une augmentation de la teneur en ozone.
Les variations nycthémérales (c'est-à-dire les variations de concentrations selon un rythme de 24 heures) de l'ozone résultent de cet équilibre. La journée, sous l'influence des rayons solaires, l'ozone est formé à partir du dioxyde d'azote (la destruction continue, mais l'effet global observé est une augmentation de l'ozone). Pendant la nuit, seule la réaction de destruction subsiste et l'ozone diminue en formant une «réserve» de dioxyde d'azote qui pourra reformer de l'ozone le jour suivant.
En été, on observe une augmentation de la concentration d'ozone entre 10 et 21 h, puis une diminution, due au processus de destruction. Les variations d'ozone dépendent de sa destruction plus ou moins forte et, selon le type d'environnement, il existe des différences notables entre ces variations nycthémérales.
Dans un environnement urbain, la production d'ozone est forte pendant la journée et sa destruction est rapide pendant la nuit. Les pics sont bien marqués, alors qu'en milieu rural et en l'absence de NO, la destruction est plus faible et les variations sont moindres, bien que le niveau général soit plus élevé (ligne de base plus haute).
Effets de l'Ozone
Les effets de l'ozone portent surtout sur le système respiratoire.
Les concentrations en ozone varient en fonction des conditions météorologiques et des niveaux de pollution en COVs et NOx de la zone concernée. A titre d'exemple, alors que le niveau général de l'ozone est resté très élevé, on peut trouver dans une rue "canyon" des concentrations faibles, phénomène dû à la destruction locale de l'ozone par le NO émis par le trafic.